 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
人类的生活离不开金属,用我们学到的化学知识和方法能分析和解释许多现象.()印刷铜制电路板的“腐
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“人类的生活离不开金属,用我们学到的化学知识和方法能分析和解释…”相关的问题
更多“人类的生活离不开金属,用我们学到的化学知识和方法能分析和解释…”相关的问题
解释下列现象。
(1)久置的SnCl2溶液会失效。
(2)于HgCl2溶液中加入SnCl2溶液,先产生白色沉淀,继续加入SnCl2,沉淀转化成黑色。
(3)铁能置换Cu2+,电子工业制备电路板却用FeCl3溶液来溶解电路板上的铜。
(4)配制FeSO4溶液时,要加少量H2SO4和细铁屑。
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为铜,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3
D.正极为银,负极为铁,电解质溶液为CuSO4
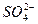 、Cl-外,还含有的金属阳离子是()
、Cl-外,还含有的金属阳离子是()A.Zn2+、Cu2+、Fe3+
B.Zn2+、Fe2+、Cu2+、Fe3+
C.Zn2+、Cu2+、Fe2+
D.Zn2+、Fe3+
A.FeCl3、BaCl2
B.CuSO4、Na2SO4
C.CuSO4、BaCl2
D.FeCl3、CuSO4
A.FeCl3溶液与铜反应:Fe3++Cu═Fe2++Cu2+
B.氢氧化镁与醋酸反应:Mg(OH)2+2H+═Mg2++2H2O
C.C12与NaOH溶液反应Cl2+2OH-═C1-+C1O-+H2O
D.碳酸氢钠溶液与少量石灰水反应:H++CO32-+Ca2++OH-═CaCO3↓+H2O
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的是________。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是______。
(4)丙组同学取10 mL 0.1mol/LKI溶液,加入6mL 0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_____(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为______。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl3溶液,溶液·变成棕黄色,发生反应的离子方程式为________;一段时间后.溶液中有气泡出现,并放热.随后有红褐色沉淀生成。产生气泡的原因是______;生成沉淀的原因是______(用平衡移动原理解释)。