 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知(S/H2S)=0.141V,(Fe3+/Fe2+)=0.771V。若向0.10mol·L-1Fe3+溶液和0.25mol·L-1HCl混合液中通入H2S气体使之
已知

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知(S/H2S)=0.141V,(Fe3+/Fe2+)=0…”相关的问题
更多“已知(S/H2S)=0.141V,(Fe3+/Fe2+)=0…”相关的问题
将10mL 0.2mol/L MgCl2溶液和10mL 0.2moVL的氨水混合,有无沉淀产生?若向混合溶液中加入0.50g固体NH4Cl(忽略体积变化),问溶液中还能否存在Mg(OH)2沉淀?(已知Ksp[Mg(OH)2]=5.61×10-12,Kb[NH3·H2O]=1.8×10-5,NH4Cl的相对分子质量为53.5)
0.25mol·L-1NaH2PO4溶液100mL和0.35mol·L-1Na2HPO4溶液50mL混合后,溶液的pH为多少?若向溶液中加入0.10mol·L-1NaOH溶液50mL,溶液的pH为多少?(假设溶液混合后的体积即为二者体积之和)
已知Mg(OH)2的溶度积Kspθ=1.8×10-11,若向Mg(OH)2的饱和溶液中加入MgCl2,并使Mg2+浓度为0.010 mol.dm-3,则该溶液的pH为 ()
A.5.26
B.4.37
C.8.75
D.9.63
求298K下,10mL 0.2mol·L-1的HAc溶液与10mL.0.2mol·L-1的NaAc溶液混合后。
(1)求该溶液的pH。
(2)若向此溶液中加入5mL0.01mol·L-1NaOH溶液,则溶液的pH又为多少?已知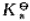 (HAc)=1.75×10-5。
(HAc)=1.75×10-5。
某溶液中原来Fe3+和Fe2+的浓度相等,若向溶液中加入KCN固体,最终使CN-离子浓度为1.0 mol.dm-3,计算这时电极反应
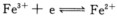 的电极电势是多少。
的电极电势是多少。
参考答案:

1、取100gNa0Ac·3H2O,加入13mL6.0mol·L-1HOAc溶液,然后用水稀释至1.0L,此缓冲溶液的pH是多少?若向此溶液中通入0.10molHCI气体(忽略溶液体积的变化),溶液pH变化多少?
电极反应 的标准电极电势为1.50V。若向溶液中加入足够的Cl-以形成[AuCl4]-,而且使溶液中Cl-的平衡浓度为1.00mol·L-1,电极电势降为1.00V,计算反应
的标准电极电势为1.50V。若向溶液中加入足够的Cl-以形成[AuCl4]-,而且使溶液中Cl-的平衡浓度为1.00mol·L-1,电极电势降为1.00V,计算反应 的标准平衡常数(
的标准平衡常数(