 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在298K时,NH4HS(s)在一真空瓶中的分解反应为 NH4HS(s)===NH3(g)+H2S(g) (1)达平衡后,测得总压为66.66kPa,
在298K时,NH4HS(s)在一真空瓶中的分解反应为
NH4HS(s)===NH3(g)+H2S(g)
(1)达平衡后,测得总压为66.66kPa,计算标准平衡常数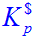 ,设气体为理想气体;
,设气体为理想气体;
(2)若瓶中已有NH3(g),其压力为40.00kPa,计算这时瓶中的总压。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“在298K时,NH4HS(s)在一真空瓶中的分解反应为 NH…”相关的问题
更多“在298K时,NH4HS(s)在一真空瓶中的分解反应为 NH…”相关的问题
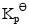 ;
;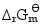 ;
;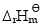 (设其不随温度而变);
(设其不随温度而变); 达平衡时,测得总压力为p,则反应的标准平衡常数
达平衡时,测得总压力为p,则反应的标准平衡常数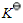 =______。
=______。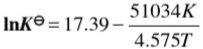 ,试计算:(1)在573K时反应的
,试计算:(1)在573K时反应的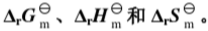 ;(2)若开始时用等物质的量的I2(g)和环戊烯(g)混合,温度为573K,起始总压为101.325kPa,达平衡后I2(g)的分压;(3)起始总压为1013.25kPa,达平衡后I2(g)的分压。
;(2)若开始时用等物质的量的I2(g)和环戊烯(g)混合,温度为573K,起始总压为101.325kPa,达平衡后I2(g)的分压;(3)起始总压为1013.25kPa,达平衡后I2(g)的分压。 H2O(g)+CO(g)
H2O(g)+CO(g)















