 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
将铜片插入含1.0mol·L-1氨水和1.0mol·L-1[Cu(NH3)4]2+的溶液中构成一个半电池,将此半电池与标准氢电极组成
将铜片插入含1.0mol·L-1氨水和1.0mol·L-1[Cu(NH3)4]2+的溶液中构成一个半电池,将此半电池与标准氢电极组成原电池,测得其电动势![将铜片插入含1.0mol·L-1氨水和1.0mol·L-1[Cu(NH3)4]2+的溶液中构成一个半](https://img2.soutiyun.com/ask/uploadfile/5988001-5991000/60f352ef11a8d604b36d3c3cff3087ed.png) =0.030V,且知标准氢电极在此作正极。试计算[Cu(NH3)4]2+的K稳。(已知:
=0.030V,且知标准氢电极在此作正极。试计算[Cu(NH3)4]2+的K稳。(已知:![将铜片插入含1.0mol·L-1氨水和1.0mol·L-1[Cu(NH3)4]2+的溶液中构成一个半](https://img2.soutiyun.com/ask/uploadfile/5988001-5991000/5b677d11c05eb19a94c57d427a82c853.png) (Cu2+/Cu)=0.337V)
(Cu2+/Cu)=0.337V)
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“将铜片插入含1.0mol·L-1氨水和1.0mol·L-1[…”相关的问题
更多“将铜片插入含1.0mol·L-1氨水和1.0mol·L-1[…”相关的问题
 上述电池,在HCl溶液中测得电动势为0.276V;在NaOH溶液测得电动势为1.036V;在100mL HCl及NaOH的混合溶液中测得电动势为0.958V。计算这100mL的混合溶液中,HCl及NaOH溶液各有多少毫升?(φSCE=0.2412V)
上述电池,在HCl溶液中测得电动势为0.276V;在NaOH溶液测得电动势为1.036V;在100mL HCl及NaOH的混合溶液中测得电动势为0.958V。计算这100mL的混合溶液中,HCl及NaOH溶液各有多少毫升?(φSCE=0.2412V)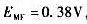 ,并知氢电极为正极,另一电极的E=-0.65V。问该氢电极中溶液的pH值和弱酸(HA)的解离常数各为多少?
,并知氢电极为正极,另一电极的E=-0.65V。问该氢电极中溶液的pH值和弱酸(HA)的解离常数各为多少?















