 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
pH=5.0时,锌和EDTA络合的条件稳定常数是多少?pH=10.0时,0.01mol·L-1锌氨溶液中,当游离[NH3]=0.10mol·L-1时,
pH=5.0时,锌和EDTA络合的条件稳定常数是多少?pH=10.0时,0.01mol·L-1锌氨溶液中,当游离[NH3]=0.10mol·L-1时,锌和EDTA络合的条件稳定常数又为多少?(Zn2+-NH3络合物的lgβ1-lgβ4分别为2.37、4.18、7.31、9.46;Zn2+-OH-络合物的lgβ1~lgβ4分别为4.4、10.1、14.2、15.5)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“pH=5.0时,锌和EDTA络合的条件稳定常数是多少?pH=…”相关的问题
更多“pH=5.0时,锌和EDTA络合的条件稳定常数是多少?pH=…”相关的问题
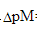 =0.2 mol·L-1,判断能否准确滴定。达化学计量点时,未络合的Zn2+百分数是多少?(pH=10.0时,αZn(OH)=102.4,lgαY(H)=0.5,lgKZnY=16.50,锌氨络合物的lgβ1~lgβ4分别为2.27、4.61、7.01、9.06
=0.2 mol·L-1,判断能否准确滴定。达化学计量点时,未络合的Zn2+百分数是多少?(pH=10.0时,αZn(OH)=102.4,lgαY(H)=0.5,lgKZnY=16.50,锌氨络合物的lgβ1~lgβ4分别为2.27、4.61、7.01、9.06 的溶液中,Zn2+/Zn电对的条件电势。忽略离子强度的影响。已知锌氨配离子的lgβ1=2.27,lgβ2=4.61,lgβ3=7.01,lgβ4=9.06,NH4+的离解常数Ka=10-9.25。
的溶液中,Zn2+/Zn电对的条件电势。忽略离子强度的影响。已知锌氨配离子的lgβ1=2.27,lgβ2=4.61,lgβ3=7.01,lgβ4=9.06,NH4+的离解常数Ka=10-9.25。















