 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
在1.00×10-3mol/L的酸性Fe3+溶液中加入过量的汞发生反应2Hg+2Fe3+—Hg2++2Fe2+。25℃达到平衡时,Fe3+和Fe2+的浓度各为4.6×10-5mol/L和9.5×10-4mol/L,则此反应的K和△q°各为()
A.0.21和0.021V
B.9.9×10-3和0.059V
C.9.8×10-3和0.12V
D.4.9和0.021V
 答案
答案
A、0.21和0.021V
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案

 更多“在1.00×10-3mol/L的酸性Fe3+溶液中加入过量的…”相关的问题
更多“在1.00×10-3mol/L的酸性Fe3+溶液中加入过量的…”相关的问题
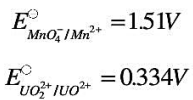 ,
,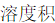 ?
?















