 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
当以镍电极做负极和标准氢电极组成原电池,c(Ni2+)=0.0100mol·dm-3时,测得此原电池电动势E=0.316 V,则镍电极
当以镍电极做负极和标准氢电极组成原电池,c(Ni2+)=0.0100mol·dm-3时,测得此原电池电动势E=0.316 V,则镍电极的标准电极电势为______。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
当以镍电极做负极和标准氢电极组成原电池,c(Ni2+)=0.0100mol·dm-3时,测得此原电池电动势E=0.316 V,则镍电极的标准电极电势为______。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“当以镍电极做负极和标准氢电极组成原电池,c(Ni2+)=0.…”相关的问题
更多“当以镍电极做负极和标准氢电极组成原电池,c(Ni2+)=0.…”相关的问题
由镍电极和标准氢电极组成原电池,若c(Ni2+)=0.0100mol·dm-3时,原电池的电动势为0.315V,其中镍为负极,计算镍电极的标准电极电势。
由标准氢电极和镍电极组成原电池。若c(Ni2+)=0.010mol·dm-3时,电池的电动势为0.316V,其中镍为负极,计算镍电极的标准电极电势。
6.由标准氢电极和镍电极组成原电池。若c(Ni2+)=0.010mol·dm-3时,电池的电动势为0.309V,其中镍为负极,计算镍电极的标准电极电势。
由标准钴电极(Co2+/Co)与标准氯电极组成原电池,测得其电动势为1.64V,此时钴电极为负极。已知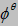 (Cl2/Cl-)=1.36V。问:(1) 标准钴电极的电极电势为多少(不查表)?(2) 此电池反应的方向如何?(3) 当氯气的压力增大或减小时,原电池的电动势将发生怎样的变化?(4) 当Co2+的浓度降低到0.010mol·dm-3时,原电池的电动势将发生怎样的变化?数值是多少?
(Cl2/Cl-)=1.36V。问:(1) 标准钴电极的电极电势为多少(不查表)?(2) 此电池反应的方向如何?(3) 当氯气的压力增大或减小时,原电池的电动势将发生怎样的变化?(4) 当Co2+的浓度降低到0.010mol·dm-3时,原电池的电动势将发生怎样的变化?数值是多少?