 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
平行反应过程优化分析 在间歇釜式反应器中进行如下反应 实验测得50℃时cp/cs恒为2,当反应10min后,A的转
平行反应过程优化分析
在间歇釜式反应器中进行如下反应

实验测得50℃时cp/cs恒为2,当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75,求k1和k2的值各为多少?又当温度提高10℃,测得cp/cs=3,试问哪个反应活化能大?两个活化能差多少?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
平行反应过程优化分析
在间歇釜式反应器中进行如下反应

实验测得50℃时cp/cs恒为2,当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75,求k1和k2的值各为多少?又当温度提高10℃,测得cp/cs=3,试问哪个反应活化能大?两个活化能差多少?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“平行反应过程优化分析 在间歇釜式反应器中进行如下反应 实验测…”相关的问题
更多“平行反应过程优化分析 在间歇釜式反应器中进行如下反应 实验测…”相关的问题
在间歇釜式反应器中进行如下反应,
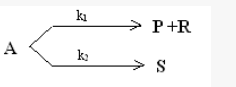 实验测得50℃时cP/cS恒为2,当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75,求k1和k2的值,又当温度提高10℃,测得cP/cS=3,试问哪个反应活化能大?两个反应活化能差多少?
实验测得50℃时cP/cS恒为2,当反应10min后,A的转化率为0.50,反应时间延长一倍,转化率为0.75,求k1和k2的值,又当温度提高10℃,测得cP/cS=3,试问哪个反应活化能大?两个反应活化能差多少?
在间歇搅拌釜式反应器中进行等温一级反应,A→R+S,已知:反应达30s时,A的转化率为90%,试求转化率达99%时还需要多少时间?
在反应体积为2.5m3的理想间歇反应器(IBR)中,维持反应温度为348K进行如下液相反应:
A+B→P
实验测得反应速率方程式为-rA=kcAcBkmol·L-1·s-1,k=2.78×10-3L·mol-1·s-1。当反应物A,B的初始浓度cA,0=cB,0=4mol·L-1,而转化率xA=80%时,该IBR平均每分钟可处理0.684kmol的反应物A。
若将反应置于一个管径为125mm的PFR中进行,反应温度不变,且处理量和要求转化率相同,试求:所需PFR的长度为多少。
反应活化能的估计
在温度为25℃时,当温度升高10℃反应速率增加1倍,则该反应活化能应为多少?
(1)C2H4的二聚反应,反应温度为200℃,反应活化能E=156.9kJ/mol
(2)C2H6的二聚反应,反应温度为200℃,反应活化能E=104.6kJ/mol
为使反应速率提高一倍,计算所需提高的温度为多少?并讨论所计算的结果。
末期反应时间与转化率
蔗糖在稀水溶液中水解生成葡萄糖和果糖的反应为
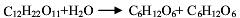

当水大大过量时,反应遵循一级反应动力学,即(-rA)=kcA,在催化剂HCl浓度为0.01mol/L,反应温度为48℃时,反应速率常数为k=0.0193min-1。当蔗糖的浓度为0.1mol/L和0.5mol/L时计算:
(1)反应20min后,上述两种初始浓度下反应液中蔗糖、葡萄糖和果糖的浓度分别为多少?
(2)试计算两种初始浓度的溶液中蔗糖的转化率各为多少?
(3)若蔗糖浓度降到0.01min/L时,两种初始浓度条件下所需反应时间各为多少?
双分子可逆反应的计算
在100℃下进行酯化反应,采用盐酸作催化剂,反应式为
CH3COOH+C2H5OH=====CH3COOC2H5+H2O
(A) (B) (P) (S)
反应动力学方程为
(-rA)=k1cAcB-k2cPcS
其中:k1=4.76×10-4m3/(kmol·min)
k2=1.63×10-4m3/(kmol·min)
若反应在一间歇反应器中进行,投料量为0.3785m3水溶液,其中含有90.8kg乙酸和181.6kg乙醇。反应过程物系的密度为1043kg/m3,计算反应120min时,乙酸的转化率为多少?其平衡转化率为多少?
对于反应:2NOCl(g)====2NO(g)+Cl2(g)经实验测得300K时,k1=2.8×10-5L·mol-1·s-1,400K时,k2=7.0×10-1L·mol-1·s-1,求反应的活化能。