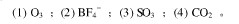题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
等性sp,sp2,sp3杂化轨道的几何构型分别为______、______、______。
等性sp,sp2,sp3杂化轨道的几何构型分别为______、______、______。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
等性sp,sp2,sp3杂化轨道的几何构型分别为______、______、______。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“等性sp,sp2,sp3杂化轨道的几何构型分别为______…”相关的问题
更多“等性sp,sp2,sp3杂化轨道的几何构型分别为______…”相关的问题
判断下列分子的几何构型、键角、中心原子的杂化轨道类型,并判断分子的极性。