 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[单选题]
用pH玻璃电极为指示电极,以0.2000mol·L-1NaOH溶液滴定0.02000mol·L-1苯甲酸溶液。从滴定曲线上求得终点时pH=8.22,二分之一终点时溶液的pH=4.18,则苯甲酸的Ka为______。
A.6.0×10-9;
B.6.6×10-5;
C.6.6×10-9;
D.数据少无法确定。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.6.0×10-9;
B.6.6×10-5;
C.6.6×10-9;
D.数据少无法确定。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用pH玻璃电极为指示电极,以0.2000mol·L-1 Na…”相关的问题
更多“用pH玻璃电极为指示电极,以0.2000mol·L-1 Na…”相关的问题
A.6.0×10-9
B.6.6×10-5
C.6.6×10-9
D.数据少无法确定
用玻璃电极作指示电极,以0.200mol·L-1苯甲酸溶液,从滴定曲线上求得终点时溶液的pH为8.22,二分之一终点时溶液pH为4.18,试计算苯甲酸的解离常数。
用pH玻璃电极作指示电极,SCE作为参比电极,用0.1010mol·L-1NaOH标准溶液滴定25.00mLHCl溶液,测得终点附近的数据如下:
(1)用二级微商法计处滴定终点体积;
(2)计算HCl溶液的浓度。
取苯甲酸溶液25.00mL,用NaOH(0.1000mol·L-1)滴定,误选甲基红作指示剂。当滴定剂加到20.70mE时,达到终点的pH为6.20。计算:
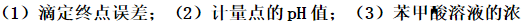 度。
度。
某10.00mL浓度约为0.01mol·L-1的NaOH溶液,以电解产生的H+进行滴定,用pH计指示滴定过程中pH的变化,确定终点。当达到终点时,通过电流的时间为6.9min,滴定时电流为20mA,计算此NaOH溶液的浓度。
计算在H2SO4介质中,用0.1000mol·L-1Ce4+溶液滴定0.1000mol·L-1Fe2+溶液时,化学计量点时的电势及滴定曲线上的突跃范围电势;选用什么指示剂指示滴定终点较合适?(已知: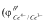 =0.68V,
=0.68V,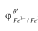 =1.28V)
=1.28V)