 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
计算在1mol·dm-3HCl溶液中用Fe3+溶液滴定Sn2+的电势突跃范围。在此滴定中应选用什么指示剂?若用所选指示剂,
计算在1mol·dm-3HCl溶液中用Fe3+溶液滴定Sn2+的电势突跃范围。在此滴定中应选用什么指示剂?若用所选指示剂,滴定终点是否和化学计量点一致?
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算在1mol·dm-3HCl溶液中用Fe3+溶液滴定Sn2+的电势突跃范围。在此滴定中应选用什么指示剂?若用所选指示剂,滴定终点是否和化学计量点一致?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“计算在1mol·dm-3HCl溶液中用Fe3+溶液滴定Sn2…”相关的问题
更多“计算在1mol·dm-3HCl溶液中用Fe3+溶液滴定Sn2…”相关的问题
14.计算在1mol·dm-3HCl溶液中用Fe3+溶液滴定Sn2+的电势突跃范围。在此滴定中应选用什么指示剂?若用所选指示剂,滴定终点是否和化学计量点一致?
计算在1mol·L-1HCl溶液中用Fe3+滴定Sn2+的电势突跃范围。在此滴定中应选用什么指示剂?若用所选指示剂,滴定终点是否和化学计量点符合?
计算在1mol·dm-3HCl溶液中用Fe3+溶液滴定Sn2+的电势突跃范围。在此滴定中应选用什么指示剂,滴定终点是否和化学计量点一致?
计算在H2SO4介质中,用0.1000mol·L-1Ce4+溶液滴定0.1000mol·L-1Fe2+溶液时,化学计量点时的电势及滴定曲线上的突跃范围电势;选用什么指示剂指示滴定终点较合适?(已知: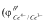 =0.68V,
=0.68V,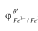 =1.28V)
=1.28V)
计算在0.1000mol/LHCl溶液中,用Fe3+液滴定Sn2+溶液的化学计量点、电位突跃范围。( =0.70V,
=0.70V, =0.14V)
=0.14V)
计算在1mol·L-1HCl溶液中,用Fe3+滴定Sn2+时化学计量点的电势,并计算滴定至99.9%和100.1%时的电势。说明为什么化学计量点前后,同样改变0.1%,电势的变化不相同。若用电势滴定判断终点,与计算所得化学计量点电势一致吗?
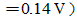
A.弱酸的离解常数越大,突跃范围越小
B.突跃范围与离解常数和浓度有关,离解常数和浓度越大,突跃范围越大
C.滴定终点、化学计量点与指示剂变色点三者必须一致
D.弱碱的离解常数越小,突跃范围越大