 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
请回答下列有关氮元素性质的问题:(1)为什么N-N键的键能(167kJ.mol-1)比P-P键(201kJ.mol卐
请回答下列有关氮元素性质的问题:
(1)为什么N-N键的键能(167kJ.mol-1)比P-P键(201kJ.mol-1)的小?而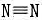 键的键能(942kJ.mol-1)又比
键的键能(942kJ.mol-1)又比 键(481kJ.Mol-1)的大?
键(481kJ.Mol-1)的大?
(2)为什么氮不能形成五卤化物?
(3)为什么N2的第一电离能比N原子的小?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“请回答下列有关氮元素性质的问题:(1)为什么N-N键的键能(…”相关的问题
更多“请回答下列有关氮元素性质的问题:(1)为什么N-N键的键能(…”相关的问题

 2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。
2NaH)。生成物氢化钠的电子式为__________,含有的化学键为_______键(填“离子”、“共价”或“金属”)。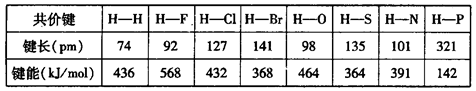
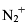 而O2分子的键能却小于
而O2分子的键能却小于 ?
?















