 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
已知Hg2Cl2的溶度积为2.0×10-18,KCl的溶解度为4.37mol/L,,计算饱和甘汞电极的电极电势。
已知Hg2Cl2的溶度积为2.0×10-18,KCl的溶解度为4.37mol/L,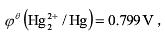 ,计算饱和甘汞电极的电极电势。
,计算饱和甘汞电极的电极电势。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知Hg2Cl2的溶度积为2.0×10-18,KCl的溶解度为4.37mol/L,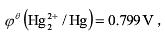 ,计算饱和甘汞电极的电极电势。
,计算饱和甘汞电极的电极电势。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知Hg2Cl2的溶度积为2.0×10-18,KCl的溶解度…”相关的问题
更多“已知Hg2Cl2的溶度积为2.0×10-18,KCl的溶解度…”相关的问题
已知Hg2Cl2的溶度积为2.0×10-18,KCl的溶解度为330g/L,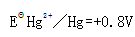 。试计算饱和甘汞电极的电极电势。
。试计算饱和甘汞电极的电极电势。
甘汞电极Hg2Cl2/Hg与Hg2+/Hg电极的标准电极电势,______较高。甘汞电极的电极反应为______,能斯特方程为______,其电极电势受______浓度的控制,故饱和甘汞电极电极电势十分______,常作______电极使用。
 (Ag+/Ag)=0.7991V,Ag2C2O4的溶度积为3.4×10-11,计算电极反应
(Ag+/Ag)=0.7991V,Ag2C2O4的溶度积为3.4×10-11,计算电极反应 的标准电极电势
的标准电极电势A.Hg/Hg2Cl2(1mol/L)/KCl(饱和)
B.Hg/Hg2Cl2(固)/KCl(饱和)
C.Hg/Hg2Cl2(固)/KCl(1mol/L)
D.Hg/HgCl2(固)/KCl(饱和)
A.Hg|Hg2Cl2(1 mol·L-)| KCl(饱和);
B.Hg|Hg2Cl2(固)|KCl(饱和);
C.Hg|Hg2Cl2(固)| HCl(1 mol·L-1);
D.Hg|HgCl2(固)| KCl(饱和)。
以银(Ag)电极为指示电极,与饱和甘汞电极组成测量电池。用0.100mol·L-1AgNO3溶液滴定100mL0.0200mol·L-1NaI溶液。试计算:①化学计算点时银电极的电极电势。②化学计量点后过量1.00mLAgNO3溶液时的电池电动势。