 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用下述电池,通过电池电位确定的浓度。 Ag|Ag2CrO4(固),||SCE(式中SCE表示饱和甘汞电极,φSCE=0.242) (1)假
用下述电池,通过电池电位确定
Ag|Ag2CrO4(固),
(1)假如忽略液接电位,试推导出电池电位与
(2)当电池电位为-0.285时,计算
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用下述电池,通过电池电位确定
Ag|Ag2CrO4(固),
(1)假如忽略液接电位,试推导出电池电位与
(2)当电池电位为-0.285时,计算
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“用下述电池,通过电池电位确定的浓度。 Ag|Ag2CrO4(…”相关的问题
更多“用下述电池,通过电池电位确定的浓度。 Ag|Ag2CrO4(…”相关的问题
由标准氢电极与饱和甘汞电极(SCE)组成电池:
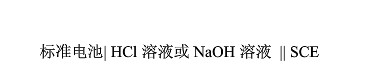 上述电池,在HCl溶液中测得电动势为0.276V;在NaOH溶液测得电动势为1.036V;在100mL HCl及NaOH的混合溶液中测得电动势为0.958V。计算这100mL的混合溶液中,HCl及NaOH溶液各有多少毫升?(φSCE=0.2412V)
上述电池,在HCl溶液中测得电动势为0.276V;在NaOH溶液测得电动势为1.036V;在100mL HCl及NaOH的混合溶液中测得电动势为0.958V。计算这100mL的混合溶液中,HCl及NaOH溶液各有多少毫升?(φSCE=0.2412V)
测得电池Pt,H2(101.325kPa)|HAc(0.01mol/L)‖SCE(饱和甘汞电极)的电动势为0.443V,计算醋酸的离解常数。
已知 ,试证明当c(Zn2+)=0.001mol·L-1时,锌电极对饱和甘汞电极的电极电位为-1.095V。(φSCE=0.245V)
,试证明当c(Zn2+)=0.001mol·L-1时,锌电极对饱和甘汞电极的电极电位为-1.095V。(φSCE=0.245V)
下列电池(25℃):
S2-选择性电极|S2-(a=1.00×10-3mol·L-1)||SCE
其电动势为0.315V。用未知硫离子S2-溶液代替上述已知浓度的S2-溶液,测得电动势为0.248V。试计算未知溶液中S2-浓度。(液接电位忽略不计)
准确量取30.00 mL弱酸HA,加水稀释至100.00 mL,在电池:(—)SHE|HA || SCE()中,以0.100 0 mol·L-1NaOH标准溶液滴定之。25℃时,当弱酸HA被中和一半时,电池电动势为0.524 V,化学计量点时,电池电动势为0.749 V。求:(1)弱酸HA的电离常数Kα值。(2)原弱酸HA溶液的浓度?(已知饱和甘汞电极的电极电位为0.244 V)
A.A.饱和甘汞电极
B.B.带KCl盐桥的SCE
C.C.Ag|AgCl(s),KCl(饱和)
D.D.带KNO3盐桥的SCE
E.E.带NaNO3盐桥的Ag—AgCl电极
用Cl-选择性电极作负极,SCE作正极组成电池,测定某溶液中氯化物的含量。取100mL此溶液在25℃时测得电池电动势为28.8mV,加入1.00mL浓度为0.475mol·L-1的经酸化的NaCl标准溶液后,测得电池电动势为53.5mV。求该溶液中氯化物的浓度(mol·L-1)。
下列电池的电位是0.413V,计算弱酸HA的电离常数(已知φSCE=0.242V)。Pt,H2(1.00atm)|HA(0.215mol),NaA(0.116mol/L)||SCE
用Cl-选择性电极作负极,饱和甘汞电极作正极组成电池测定某溶液中氯化物含量。取100mL此溶液在25℃时测得电池电动势为28.8mV。加入1.00mL浓度为0.475mol·L-1的经酸化的NaCl标准溶液后,测得电池电动势为53.5mV。求该溶液中氯化物浓度。
25℃时,下列电池的电动势为0.411V:
(—)镁离子电极|Mg2+(1.8×10-3mol·L-1)||饱和甘汞电极()
用含Mg2+试液代替已知浓度的溶液时,测得电池的电动势为0.439V,求试液中的pMg。