 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
已知某气相反应的活化能Ea=163kJ·mol-1,390K时的速率常数k= 2.37×10-2dm3·mol-1·s-1,试求420K时的速率常数。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“已知某气相反应的活化能Ea=163kJ·mol-1,390K…”相关的问题
更多“已知某气相反应的活化能Ea=163kJ·mol-1,390K…”相关的问题
已知某气相反应的活化能Ea=163kJ·mol-1,温度390K时的速率常数k=2.37×10-2dm3·mol-1·s-1。试求温度为420K时的反应速率常数。
已知某反应288K时,速率常数为3.1×10-3,而313K时速率常数为1.5×10-2,求该反应的活化能。
已知65℃时N2O5气相分解反应速率常数的单位是min-1,半衰期为2.37min,反应的活化能为103.3kJ·mol-1,求80℃时的速率常数。
双环戊烯单分子气相热分解反应,在483K时的速率常数k(483K)=2.05×10-4s-1,在545K时的速率常数k(545K)=1.86×10-2s-1。已知kB=1.38×10-23J·K-1,h=6.626×10-34J·s。
试计算:
(1)反应的活化能Ea
(2)反应在500K时的活化焓和活化熵
某基元反应:A→B其活化能Ea=60.4kg·mol-1,逆反应的活化能E'a=95.6kg·mol-1,
(1)试结合图1.18.1所示的反应进程-势能图,定性判断该反应是吸热反应,还是放热反应,求算该反应的ΔtH;
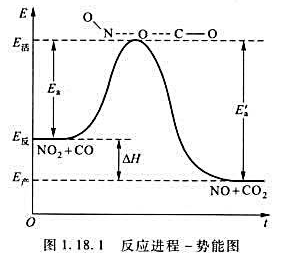
(2)若298K时的速率常数k=2.3×10-2s-1。试求373K时的速率常数;
(3)求算阿伦尼乌斯公式中的指前因子A。
已知反应:C2H5Br(g)→C2H4(g)+HBr(g),其活化能是226kJ·mol-1,650K时,速率常数为2.0×10-5s-1,试计算在哪个温度时速率常数是6.0×10-5s-1?
CH4气相热分解反应2CH4→C2H6+H2的反应机理及各基元反应的活化能如下:

已知该总反应的速率方程式为:
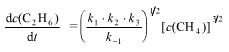
试求总反应的表观活化能。