 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
某弱酸HB在水中的Ka=4.2×10-5,在水相与某有机相中的分配系数Ka=44.5.若将HB从50.0mL的水溶液中萃取到10.0mL有机溶剂中,试分别计算pH=1.0和pH=5.0时的萃取百分率(假设HB在有机相中仅以HB一种型体存在),
某弱酸HB在水中的Ka=4.2×10-5,在水相与某有机相中的分配系数Ka=44.5.若将HB从50.0mL的水溶液中萃取到10.0mL有机溶剂中,试分别计算pH=1.0和pH=5.0时的萃取百分率(假设HB在有机相中仅以HB一种型体存在),
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“某弱酸HB在水中的Ka=4.2×10-5,在水相与某有机相中…”相关的问题
更多“某弱酸HB在水中的Ka=4.2×10-5,在水相与某有机相中…”相关的问题
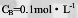 的溶液的pH值为( )。
的溶液的pH值为( )。















