 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
写出下列电池的电池反应。计算25℃时的电动势,并指明能否自发进行(X表示卤素)。 Pt|X2(p)|X-{a(X-)=0.1}||X-{
写出下列电池的电池反应。计算25℃时的电动势,并指明能否自发进行(X表示卤素)。
Pt|X2(p)|X-{a(X-)=0.1}||X-{a(X-)=0.001}|X2(p)|Pt
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
写出下列电池的电池反应。计算25℃时的电动势,并指明能否自发进行(X表示卤素)。
Pt|X2(p)|X-{a(X-)=0.1}||X-{a(X-)=0.001}|X2(p)|Pt
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“写出下列电池的电池反应。计算25℃时的电动势,并指明能否自发…”相关的问题
更多“写出下列电池的电池反应。计算25℃时的电动势,并指明能否自发…”相关的问题
写出下列各电池的电池反应。应用表7.7.1(在教材中)的数据计算25℃时各电池的电动势及电池反应的摩尔吉布斯函数变,并指明各电池反应能否自发进行。
(1)Pt|H2(g,100kPa)|HCl[a(HCl)=1]|Cl2(g,100kPa)|Pt
(2)Zn|ZnCl2[a(ZnCl2)=0.5]|AgCl(S)|Ag
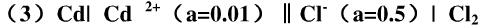
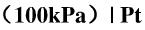
写出下列电池的电池反应:
Cd(s)|Cd2+(a=0.01)|Cl-(a=0.5)|Cl2(100kPa)|Pt,并计算298K时,各电极的电极电势及电池电动势,根据计算结果指出此电池反应能否自发进行?
写出下列各电池的电池反应。应用表7.7.1(在教材中)的数据计算25℃时各电池的电动势、各电池反应的摩尔吉布斯函数变及标准平衡常数,并指明各电池反应能否自发进行。
(1)Cd|Cd2+{a(Cd2+)=0.01}||Cl-{a(Cl-)=0.5}|Cl2(g,100kPa)|Pt
(2)Pb|Pb2+{a(Pb2+)=1}||Ag+{a(Ag+)=1}|Ag
(3)Zn|Zn2+{a(Zn2+)=0.0004}||Cd2+{a(Cd2+)=0.2}|Cd

(1)写出电池符号;
(2)计算298K时的电动势,并判断反应自发进行的方向;
已知
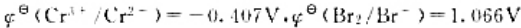
5.写出下列原电池的电极反应式和电池反应式,并计算25℃时原电池的电动势。
Fe|Fe2+(1.0mol/L)||Cl-(1.0mol/L)|Cl2(100kpa),Pt