 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试通过计算回答: (1)写出氢-氧燃料电池的电池总反应式。 (2)计算该电池的标准电动势(Eθ)。
试通过计算回答: (1)写出氢-氧燃料电池的电池总反应式。 (2)计算该电池的标准电动势(Eθ)。 (3)燃烧1mol氢气可获得的最大电功是多少?若该燃料电池的转化率为83.0%,则燃烧1mol氢气又可获得电功为多少(以千焦计)?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试通过计算回答: (1)写出氢-氧燃料电池的电池总反应式。 (2)计算该电池的标准电动势(Eθ)。 (3)燃烧1mol氢气可获得的最大电功是多少?若该燃料电池的转化率为83.0%,则燃烧1mol氢气又可获得电功为多少(以千焦计)?
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“试通过计算回答: (1)写出氢-氧燃料电池的电池总反应式。 …”相关的问题
更多“试通过计算回答: (1)写出氢-氧燃料电池的电池总反应式。 …”相关的问题
(1)分别写出两电对的电极反应。
(2)写出以Cr电极为正极、以Cl电极为负极所构成的原电池的电池符号和电池反应。计算该原电池的标准电动势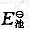 ,298K时电池反应的
,298K时电池反应的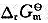 和平衡常数KΘ。
和平衡常数KΘ。
(3)若仅负极中盐酸的浓度改为10mol•dm-3,计算此时该原电池的电动势E池。
(4)若正、负极中盐酸的浓度均改为10mol•dm-3,计算此时该原电池的电动势E池。
标准状态下,由电对Ni2+/Ni和Pb2+/Pb组成电池。
(1)写出电池符号和电池反应方程式。
(2)计算电池电动势、电池反应的标准吉布斯自由能和平衡常数。
(3)在两电池溶液中同时加入S2-溶液,并使之都达到c(S2-)=1mol·L-1,求两电对的电极电势值,电池电动势和电池反应方向。
 为1.40×10-4V/K。
为1.40×10-4V/K。
已知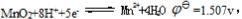 Fe3++e-===Fe2+EΘ=0.771V
Fe3++e-===Fe2+EΘ=0.771V
(1)判断下列反应的方向,并配平
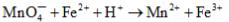
(2)将这两个半电池组成原电池,用电池符号表示该原电池的组成,标明电池的正、负极,并计算其标准电动势。
(3)当氢离子浓度为10mol·L-1,其他各离子浓度均为1mol·L-1时,计算该电池的电动势。

A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2=2H2O
(1)试用水的标准摩尔生成吉布斯函数计算在25℃于氢-氧燃料电池中进行反应H2(g,100kPa)+(1/2)O2(g,100kPa)===H2O(l)时的电动势。
(2)应用表7.7.1(在教材中)的数据计算上述电池的电动势。
(3)已知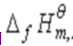 (H2O,l)=-285.83kJ·mol-1,计算上述电池电动势的温度系数。
(H2O,l)=-285.83kJ·mol-1,计算上述电池电动势的温度系数。