 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
欲配pH=10.0的缓冲溶液,计算应在300mL0.5mol·L-1 NH3·H2O溶液中加入NH4Cl的质量。
欲配pH=10.0的缓冲溶液,计算应在300mL0.5mol·L-1NH3·H2O溶液中加入NH4Cl的质量。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
欲配pH=10.0的缓冲溶液,计算应在300mL0.5mol·L-1NH3·H2O溶液中加入NH4Cl的质量。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“欲配pH=10.0的缓冲溶液,计算应在300mL0.5mol…”相关的问题
更多“欲配pH=10.0的缓冲溶液,计算应在300mL0.5mol…”相关的问题
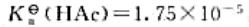
欲配制pH值为3.0和4.0的HCOOH-HCOONa缓冲溶液,应分别往200mL0.20mol·L-1HCOOH溶液中加入多少毫升1.0mol·L-1Na0H溶液?
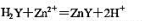 。滴定开始时,pH=5.50,若溶液中无缓冲溶液,滴定至终点时,溶液的pH为多少?通过计算说明EDTA配位滴定时加入缓冲溶液的必要性。
。滴定开始时,pH=5.50,若溶液中无缓冲溶液,滴定至终点时,溶液的pH为多少?通过计算说明EDTA配位滴定时加入缓冲溶液的必要性。
欲配制250mLpH=5.00的缓冲溶液,问在125mL1.00mol·dm-3的NaAc溶液中需加入多少体积6.00mol·dm-3的HAc溶液?[已知Ka(HAc)=1.75×10-5]。