 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。
N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。

查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已知其在某温度下的速率常数为4.8×10-4s-1。

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已…”相关的问题
更多“N2O5分解反应N2O5→2NO2+1/2O2是一级反应,已…”相关的问题
在318.15K时,已知CCl4溶液中N2O5的分解反应:
2N2O5→4NO2+O2
为一级反应。
(1)当N2O5的起始浓度c0(N2O5)=0.50mol·L-1时,测得其起始反应速率为υ0=3.25×10-4mol·L-1·min-1,求该反应的转化率。
已知65℃时N2O5气相分解反应速率常数的单位是min-1,半衰期为2.37min,反应的活化能为103.3kJ·mol-1,求80℃时的速率常数。
 2NO2(g),反应平衡常数
2NO2(g),反应平衡常数298K时,N2O5(g)====N2O4(g)+O2(g),该分解反应的半衰期t1/2=5.7h,此值与N2O5(g)的起始浓度无关。试求:
(1) 该反应的速率常数;
(2) N2O5(g)转化掉90%所需的时间。
 试计算: (1)在0~2.0 min内的平均反应速率:△c(O2)/△t=? (2)在第2.0 min时的瞬时速率:-dc(N2O5)/dt=? (3) N2O5浓度为1.00 mol.dm-3时的初速率:~dc(N2O5)/dt=?
试计算: (1)在0~2.0 min内的平均反应速率:△c(O2)/△t=? (2)在第2.0 min时的瞬时速率:-dc(N2O5)/dt=? (3) N2O5浓度为1.00 mol.dm-3时的初速率:~dc(N2O5)/dt=?
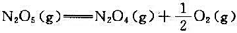 ,该分解反应的半衰期t1/2=5. 7 h,此值与N2O5(g)的起始浓度无关。试求:(1)该反应的速率常数;(2) N2O5(g)转化掉90%所需的时间。
,该分解反应的半衰期t1/2=5. 7 h,此值与N2O5(g)的起始浓度无关。试求:(1)该反应的速率常数;(2) N2O5(g)转化掉90%所需的时间。