 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
指出BeH2、BF3、CCl4、PH3和H2S分子中中心原子可能采取的杂化类型,并预测其空间构型及分子的极性。
指出BeH2、BF3、CCl4、PH3和H2S分子中中心原子可能采取的杂化类型,并预测其空间构型及分子的极性。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
指出BeH2、BF3、CCl4、PH3和H2S分子中中心原子可能采取的杂化类型,并预测其空间构型及分子的极性。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“指出BeH2、BF3、CCl4、PH3和H2S分子中中心原子…”相关的问题
更多“指出BeH2、BF3、CCl4、PH3和H2S分子中中心原子…”相关的问题
BCl3,CH3Cl,PF3、CS2
指出下列化合物的中心原子可能的杂化轨道类型,并预测其分子几何构型:
BeH2BBr3SiH4CH3Cl OF2
判断下列分子的几何构型、键角、中心原子的杂化轨道类型,并判断分子的极性。
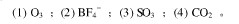
用价层电子对互斥理论判断HNO2分子的构型,试分析中心原子的杂化方式、成键类型,并预测分子的极性。
BeH2BCl3SiH4PH3SeF6SnCl2CCl2F2NF3
用价层电子对互斥理论和杂化轨道指出下列各分子的空间构型和中心原子的杂化轨道类型。
PCl3SO2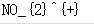 SCl2SnCl2
SCl2SnCl2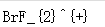
用杂化轨道理论判断下列各物质的杂化类型,预测各分子的空间构型并判断分子有无极性。
SiH4、CS2、PH3、OF2、BBr3、CO_{3}^{2-}、CH4