 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
0.200g某含锰试样中的锰的含量的分析过程如下:加入50.0mL0.100mol•L-1(NH4)2Fe(SO4)2标准溶液
0.200g某含锰试样中的锰的含量的分析过程如下:加入50.0mL0.100mol•L-1(NH4)2Fe(SO4)2标准溶液还原MnO2到Mn2+,完全反应后,过量的Fe2+在酸性溶液中被0.0200mol•L-1KMnO4标准溶液滴定,需KMnO4溶液15.0mL。以Mn3O4(M=228.8g•mol-1)的形式计算该试样中锰的含量。

 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“0.200g某含锰试样中的锰的含量的分析过程如下:加入50.…”相关的问题
更多“0.200g某含锰试样中的锰的含量的分析过程如下:加入50.…”相关的问题
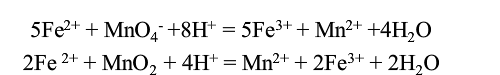
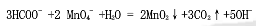 今称取HCOONa试样0.5000g,溶于水后,在中性介质中加入过量的0.06000mol·L-1KMnO4溶液50.00mL,过滤除去MnO2沉淀,以H2SO4酸化溶液后,用0.1000mol·L-1H2C2O4溶液滴定过量的KMnO4至终点,消耗25.00mL。计算试样中HCOONa的含量。[M(HCOONa)=68.00g·mol-1]
今称取HCOONa试样0.5000g,溶于水后,在中性介质中加入过量的0.06000mol·L-1KMnO4溶液50.00mL,过滤除去MnO2沉淀,以H2SO4酸化溶液后,用0.1000mol·L-1H2C2O4溶液滴定过量的KMnO4至终点,消耗25.00mL。计算试样中HCOONa的含量。[M(HCOONa)=68.00g·mol-1]















