 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
指出F2O分子中的氧原子的杂化轨道类型以及分子的几何构型。F2O与H2O分子比较,哪一个的偶极矩大,简单说明原因
指出F2O分子中的氧原子的杂化轨道类型以及分子的几何构型。F2O与H2O分子比较,哪一个的偶极矩大,简单说明原因。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
指出F2O分子中的氧原子的杂化轨道类型以及分子的几何构型。F2O与H2O分子比较,哪一个的偶极矩大,简单说明原因。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“指出F2O分子中的氧原子的杂化轨道类型以及分子的几何构型。F…”相关的问题
更多“指出F2O分子中的氧原子的杂化轨道类型以及分子的几何构型。F…”相关的问题
指出下列各分子中各个C原子所采用的杂化轨道:
分子 杂化轨道类型 空间构型①CH4______、______;②C2H4______、______;③C2H2______、______。
判断下列分子的几何构型、键角、中心原子的杂化轨道类型,并判断分子的极性。
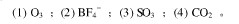
(1)分子极性的大小 (2)中心原子的杂化轨道类型 (3)分子的几何构型