 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
有正、逆反应均为一级反应的对峙反应A B,已知其速率常数和平衡常数与温度的关系分别为反应开始
有正、逆反应均为一级反应的对峙反应A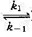 B,已知其速率常数和平衡常数与温度的关系分别为
B,已知其速率常数和平衡常数与温度的关系分别为
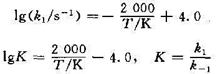
反应开始时,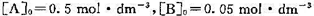 。试计算:(1)逆反应的活化能;(2)400 K时,反应10s后,A和B的浓度;(3) 400 K时,反应达平衡后,A和B的浓度。
。试计算:(1)逆反应的活化能;(2)400 K时,反应10s后,A和B的浓度;(3) 400 K时,反应达平衡后,A和B的浓度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
有正、逆反应均为一级反应的对峙反应A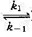 B,已知其速率常数和平衡常数与温度的关系分别为
B,已知其速率常数和平衡常数与温度的关系分别为
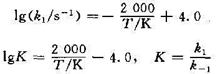
反应开始时,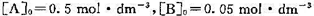 。试计算:(1)逆反应的活化能;(2)400 K时,反应10s后,A和B的浓度;(3) 400 K时,反应达平衡后,A和B的浓度。
。试计算:(1)逆反应的活化能;(2)400 K时,反应10s后,A和B的浓度;(3) 400 K时,反应达平衡后,A和B的浓度。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“有正、逆反应均为一级反应的对峙反应A B,已知其速率常数和平…”相关的问题
更多“有正、逆反应均为一级反应的对峙反应A B,已知其速率常数和平…”相关的问题
有正、逆反应均为一级反应的对峙反应 ,已知其速率常数和平衡常数与温度的关系分别为
,已知其速率常数和平衡常数与温度的关系分别为
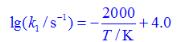
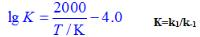 ,
,
反应开始时,[A]0=0.5mol·dm-3,[B]0=0.05mol·dm-3。试计算:
(1)逆反应的活化能;
(2)400k时,反应10s后,A和B的浓度;
(3)400k时,反应达到平衡时,A和B的浓度.
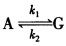 ,在某温度下测得如下数据,反应开始时G的浓度为零,求:(1)反应的平衡常数;(2)正、逆反应的速率常数。
,在某温度下测得如下数据,反应开始时G的浓度为零,求:(1)反应的平衡常数;(2)正、逆反应的速率常数。

下列说法是否正确?为什么?
①化学反应的活化能越小,反应速率越慢。
②正、逆反应的活化能在数值上相等,但符号相反。
③加入催化剂后,可以降低反应活化能,使平衡向正反应方向移动。
④在一定温度下,可逆反应达成平衡时,反应物浓度一定等于生成物的浓度。
⑤速率常数和平衡常数均与反应温度及物质本性有关,而与浓度无关。
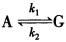 ,已知在某温度下k1=0.006min-1,k2=0.002min-1。若反应开始时只有A,浓度为1 mol/L,求:(1)反应达平衡后A和G的浓度;(2)使A和G浓度相等所需的时间;(3)反应进行至100分钟时A和G的浓度。
,已知在某温度下k1=0.006min-1,k2=0.002min-1。若反应开始时只有A,浓度为1 mol/L,求:(1)反应达平衡后A和G的浓度;(2)使A和G浓度相等所需的时间;(3)反应进行至100分钟时A和G的浓度。
A.化学反应的活化能越大,在一定的条件下其反应速率越快
B.催化剂的使用可以提高化学反应的平衡转化率
C.对某可逆反应,如果正反应的活化能比逆反应的活化能大,那么该正反应为放热反应
D.当参加反应的各物质浓度为标准浓度时,反应的速率常数在数值上等于反应的速率
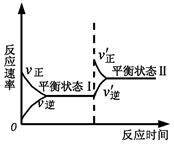
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
D.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
1-1级对峙反应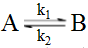 的正、逆向反应速率常数分别为k1、k2,由纯A开始反应,当进行到A和B浓度相等时的时间为( )。
的正、逆向反应速率常数分别为k1、k2,由纯A开始反应,当进行到A和B浓度相等时的时间为( )。
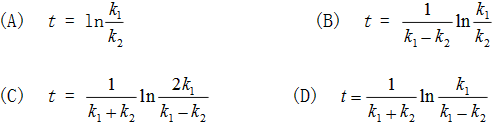
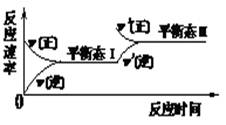
A.反应达平衡时,正反应速率和逆反应速率相等
B.同一种反应物在平衡态I和平衡态II时浓度不相等
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
(1)试结合图1.18.1所示的反应进程-势能图,定性判断该反应是吸热反应,还是放热反应,求算该反应的ΔtH;

(2)若298K时的速率常数k=2.3×10-2s-1。试求373K时的速率常数;
(3)求算阿伦尼乌斯公式中的指前因子A。