 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
900℃时氧化铜在密闭的抽空容器中分解,反应为:2CuO(s)=Cu2O(s)+O2(g),测得平衡时氧气的压力为1.672kPa,则其平衡常数Kp为:()
A.0.0165
B.0.128
C.0.00825
D.7.81
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.0.0165
B.0.128
C.0.00825
D.7.81
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“900℃时氧化铜在密闭的抽空容器中分解,反应为:2CuO(s…”相关的问题
更多“900℃时氧化铜在密闭的抽空容器中分解,反应为:2CuO(s…”相关的问题
一定温度下,将纯的NH4HS(s)置于抽空的容器内,NH4HS(s)发生分解,
测得平衡时系统总压力为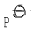 ,则标准平衡常数为
,则标准平衡常数为

在温度T时,将NH2COONH4(s)置于抽空的容器中,当反应
 达平衡时,测得总压力为p,则反应的标准平衡常数
达平衡时,测得总压力为p,则反应的标准平衡常数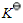 =______。
=______。
在250℃时,PCl5的分解反应:PCl5(g) =PCl3(g) + Cl2(g),其平衡常数为K,如果将一定量的PCl5放入一密闭容器中,在250℃,200kPa压力下,反应达到平衡,得容器内PCl3的浓度0.150mol/L.计算该温度下的平衡常数.
在298K时,NH4HS(s)在一真空瓶中的分解反应为
NH4HS(s)===NH3(g)+H2S(g)
(1)达平衡后,测得总压为66.66kPa,计算标准平衡常数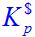 ,设气体为理想气体;
,设气体为理想气体;
(2)若瓶中已有NH3(g),其压力为40.00kPa,计算这时瓶中的总压。
 达平衡时总压力为60kPa,则此反应的标准平衡常数Kθ=().
达平衡时总压力为60kPa,则此反应的标准平衡常数Kθ=().
某容器底部装有少量水,气空间体积为0.05m3,抽空后密闭。在温度为30℃时测得容器内压力为5kPa,试确定容器内尚残存多少空气。