 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
可逆反应达平衡后,若反应速率常数k发生变化时,标准平衡常数符合下列哪一条?()A.一定发生变化B.
可逆反应达平衡后,若反应速率常数k发生变化时,标准平衡常数1.jpg) 符合下列哪一条?()
符合下列哪一条?()
A.一定发生变化
B.不变
C.不一定变化
D.与k无关
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
可逆反应达平衡后,若反应速率常数k发生变化时,标准平衡常数1.jpg) 符合下列哪一条?()
符合下列哪一条?()
A.一定发生变化
B.不变
C.不一定变化
D.与k无关
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“可逆反应达平衡后,若反应速率常数k发生变化时,标准平衡常数符…”相关的问题
更多“可逆反应达平衡后,若反应速率常数k发生变化时,标准平衡常数符…”相关的问题
(A) 一定发生变化; (B) 一定不变; (C) 不一定变化; (D) 与k无关。
 B,已知其速率常数和平衡常数与温度的关系分别为
B,已知其速率常数和平衡常数与温度的关系分别为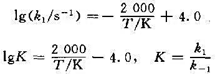
反应开始时,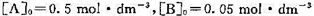 。试计算:(1)逆反应的活化能;(2)400 K时,反应10s后,A和B的浓度;(3) 400 K时,反应达平衡后,A和B的浓度。
。试计算:(1)逆反应的活化能;(2)400 K时,反应10s后,A和B的浓度;(3) 400 K时,反应达平衡后,A和B的浓度。
A.反应的热化学方程式为NO 2 ΔH>0
B.混合气体的平均摩尔质量保持不变,说明反应已达平衡
C.一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深
D.使用合适的催化剂可使该反应的反应速率和平衡常数增大
对于下列反应 (298.15K)=172.5 kJ·mol-1,若增大总压力或升高温度或加人催化剂,则反应速率常数k正、k逆,和反应速率υ正、υ逆,以及标准平衡常数
(298.15K)=172.5 kJ·mol-1,若增大总压力或升高温度或加人催化剂,则反应速率常数k正、k逆,和反应速率υ正、υ逆,以及标准平衡常数 、平衡移动方向等将如何?分别填入表2-1中。
、平衡移动方向等将如何?分别填入表2-1中。
k正
k逆
v正
v逆
K^{ominus }
平衡移动方向
增加总压力
升高温度
加入催化剂
A.活化能很小
B.反应物浓度不随时间变化
C.反应速率常数k等于零
D.反应速率与反应物浓度无关
下列说法是否正确?为什么?
①化学反应的活化能越小,反应速率越慢。
②正、逆反应的活化能在数值上相等,但符号相反。
③加入催化剂后,可以降低反应活化能,使平衡向正反应方向移动。
④在一定温度下,可逆反应达成平衡时,反应物浓度一定等于生成物的浓度。
⑤速率常数和平衡常数均与反应温度及物质本性有关,而与浓度无关。
 达平衡时总压力为60kPa,则此反应的标准平衡常数Kθ=().
达平衡时总压力为60kPa,则此反应的标准平衡常数Kθ=().