 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
将Ag—AgCl电极与饱和甘汞电极组成原电池,该原电池的电池符号为______;正极反应______;负极反应______;电池
将Ag—AgCl电极[Eθ(AgCl/Ag)=0.2222V)]与饱和甘汞电极[Eθ=0.2415V]组成原电池,该原电池的电池符号为______;正极反应______;负极反应______;电池反应______;电池反应的平衡常数为______。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
将Ag—AgCl电极[Eθ(AgCl/Ag)=0.2222V)]与饱和甘汞电极[Eθ=0.2415V]组成原电池,该原电池的电池符号为______;正极反应______;负极反应______;电池反应______;电池反应的平衡常数为______。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“将Ag—AgCl电极与饱和甘汞电极组成原电池,该原电池的电池…”相关的问题
更多“将Ag—AgCl电极与饱和甘汞电极组成原电池,该原电池的电池…”相关的问题
将Ag---AgCl电极[E(AgCl/Ag)=0.2222V]与饱和甘汞电极[E=0.2415v]组成原电池, 该原电池的电池符号为________________;正极反应________________;负极反应______________;电池反应___________________;电池的平衡常数为________________.
将标准Ag-AgCl电极Eθ(AgCl/Ag)=0.2222V与饱和甘汞电极Eθ=0.2145V组成原电池,该原电池的电池符号______;正极反应______;负极反应______;电池反应______;电池反应的平衡常数______。
写出标准锌电极 (Zn[2+/Zn)=-0.763V]与甘汞电极(
(Zn[2+/Zn)=-0.763V]与甘汞电极( =0.2415V)组成的原电池符号是______,其中正极反应是______,负极反应是______,电池反应是______,平衡常数为______。
=0.2415V)组成的原电池符号是______,其中正极反应是______,负极反应是______,电池反应是______,平衡常数为______。
将下列反应组成原电池(温度为298.15K):2Fe3++Cu====2Fe2++Cu2+
(1)计算原电池的标准电动势;(2)写出其电池符号;(3)指出正极、负极,并写出电极反应;(4)当Cu2+的浓度升到10mol·L-1时,原电池的电动势为多少?
写出电极反应及电池反应;
(1)分别写出两电对的电极反应。
(2)写出以Cr电极为正极、以Cl电极为负极所构成的原电池的电池符号和电池反应。计算该原电池的标准电动势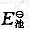 ,298K时电池反应的
,298K时电池反应的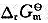 和平衡常数KΘ。
和平衡常数KΘ。
(3)若仅负极中盐酸的浓度改为10mol•dm-3,计算此时该原电池的电动势E池。
(4)若正、负极中盐酸的浓度均改为10mol•dm-3,计算此时该原电池的电动势E池。
298K时,在Ag+/Ag电极中加入过量I-,设达到平衡时c(I-)=0.1mol·dm-3,而另一电极为Cu2+/Cu,c(Cu2+)=0.01mol·dm-3,将两电极组成原电池,写出原电池符号、电池反应,并求电池反应平衡常数。
已知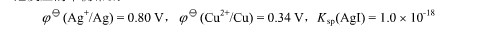
将氧化还原反应Ni+2Ag+====2Ag+Ni2+设计为一个原电池,则电池的负极为______,正极为______,原电池符号为______。若 (Ni2+/Ni)=-0.25V,
(Ni2+/Ni)=-0.25V, (Ag+/Ag)=0.80V,原电池的电动势
(Ag+/Ag)=0.80V,原电池的电动势 为______,
为______, 为______,该反应的平衡常数为______。
为______,该反应的平衡常数为______。