 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
[主观题]
在0.10mol·dm-3 CdCl2溶液中含有0.30mol·dm-3 HCl,通入H2S至饱和,达到平衡时 (1) H+浓度多大? (2) 留在
在0.10mol·dm-3CdCl2溶液中含有0.30mol·dm-3HCl,通入H2S至饱和,达到平衡时
(1) H+浓度多大?
(2) 留在溶液中的Cd2+浓度多大?
已知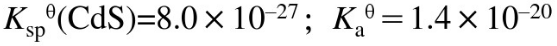 。
。
查看答案
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“在0.10mol·dm-3 CdCl2溶液中含有0.30mo…”相关的问题
更多“在0.10mol·dm-3 CdCl2溶液中含有0.30mo…”相关的问题
 }
} =6.3x10^-36,H2S的
=6.3x10^-36,H2S的 =1.3x10^-20。
=1.3x10^-20。
 =-0.7628V)
=-0.7628V)















