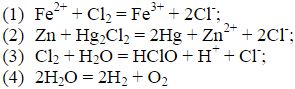题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知298K时,反应的平衡常数为9.7×10-81,这时H2O(1)的饱和蒸气压为3200Pa,试求298K时下述电池的电动势E。 Pt
已知298K时,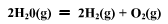 反应的平衡常数为9.7×10-81,这时H2O(1)的饱和蒸气压为3200Pa,试求298K时下述电池的电动势E。
反应的平衡常数为9.7×10-81,这时H2O(1)的饱和蒸气压为3200Pa,试求298K时下述电池的电动势E。
Pt|H2(P3)|H2SO4(0.01mol·kg-1)|O2(P3)|Pt
(298K时的平衡常数是根据高温下的数据间接求出的。由于氧电极上反应不易达到平衡,不能测出E的精确值,所以可通过此法来计算E值。)
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“已知298K时,反应的平衡常数为9.7×10-81,这时H2…”相关的问题
更多“已知298K时,反应的平衡常数为9.7×10-81,这时H2…”相关的问题
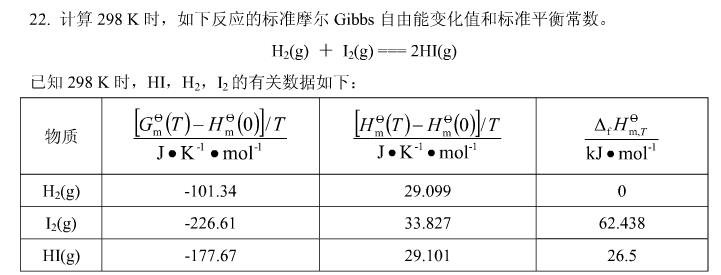
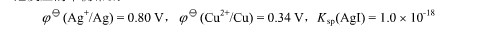
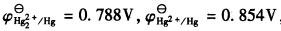 ,试计算:(1)反应Hg2++2e→
,试计算:(1)反应Hg2++2e→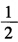 Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。
Hg22+的标准电极电势;(2)为反应Hg+Hg2+→Hg22+设计电池,并计算该反应的标准平衡常数。 。
。 的平衡常数。
的平衡常数。