 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
CO2(g)与H2S(g)在高温的反应为CO2(g)+H2S(g)===COS(g)+H2O(g),今在610K时将4.4g的CO2(g)加入体积为2.5dm3的
CO2(g)与H2S(g)在高温的反应为CO2(g)+H2S(g)===COS(g)+H2O(g),今在610K时将4.4g的CO2(g)加入体积为2.5dm3的空瓶中,然后再充入H2S(g)使总压为1000kPa。达平衡后取样分析,得其中H2O(g)的摩尔分数为0.02。将温度升至620K重复上述实验,达平衡后取样分析. 得其中H2O(g)的摩尔分数为0.03。视气体为理想气体,试计算:
(1)610K时的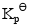 ;
;
(2)610K时的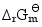 ;
;
(3)反应的标准摩尔焓变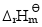 (设其不随温度而变);
(设其不随温度而变);
(4)610K时,往该体积的瓶中充入不参与反应的气体,直至压力加倍,则COS(g)的产量有何变化。若充入不参与反应的气体,保持压力不变,而使体积加倍,COS(g)的产量又有何变化。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案


 更多“CO2(g)与H2S(g)在高温的反应为CO2(g)+H2S…”相关的问题
更多“CO2(g)与H2S(g)在高温的反应为CO2(g)+H2S…”相关的问题
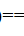 H2O(g)+CO(g)
H2O(g)+CO(g)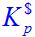 ,设气体为理想气体;
,设气体为理想气体; (C6H6,g)=82.93kJ·mol-1和
(C6H6,g)=82.93kJ·mol-1和 (C6H6,l)=49.0kJ·mol-1,纯苯在101.33kPa压力下的沸点是353K。若在298K时,甲烷溶在苯中达平衡后,溶液中甲烷的摩尔分数x(CH4)=0.0043时,其对应的气相中甲烷的分压p(CH4)=245.0kPa。试求在298K时,(1)当甲烷的摩尔分数x(CH4)=0.01时,甲烷苯溶液的总蒸气压;(2)与上述溶液对应的气相组成。
(C6H6,l)=49.0kJ·mol-1,纯苯在101.33kPa压力下的沸点是353K。若在298K时,甲烷溶在苯中达平衡后,溶液中甲烷的摩尔分数x(CH4)=0.0043时,其对应的气相中甲烷的分压p(CH4)=245.0kPa。试求在298K时,(1)当甲烷的摩尔分数x(CH4)=0.01时,甲烷苯溶液的总蒸气压;(2)与上述溶液对应的气相组成。















